必赢国际437官方分子影像与核医学研究中心李桢团队发现了具有靶向小胶质细胞及多重类酶活性的CSPQ仿生纳米颗粒可以治疗临床吸入麻醉药七氟烷引发的神经发育毒性,并揭示了相关分子机制,成果以“Boosting Microglial Lipid Metabolism via TREM2 Signaling by Biomimetic Nanoparticles to Attenuate the Sevoflurane-induced Developmental Neurotoxicity”为题发表在Advanced Science杂志上(Advanced Science. 2023 e2305989. DOI:10.1002/advs.202305989)。
论文链接: http://doi.org/10.1002/advs.202305989。
七氟烷是临床常用的全身麻醉药物之一,因其刺激性小,起效迅速,苏醒快,且麻醉深度容易控制等优点,广泛用于婴幼儿患者的麻醉诱导和维持。从麻醉实践开始直至最近,麻醉药对大脑的作用都被认为其在药物消除后是完全可逆的。然而,越来越多的证据表明,大脑功能的改变在开始麻醉后就已经发生,多次麻醉可能对婴幼儿发育期大脑产生认知损伤以及远期学习功能障碍。2016年,美国FDA (Food and Drug Administration)要求在全身麻醉药物的药品标签上增加如下警告:“三岁以下儿童或妊娠晚期孕妇在手术过程中反复或长时使用全麻及镇静药物可能会影响儿童大脑的发育”。因此,探究吸入麻醉药引发的神经发育毒性的发生机制及治疗策略具有重要意义。
小胶质细胞是中枢神经系统的重要免疫细胞,发挥着对受损的神经元进行修剪、吞噬、清除等重要作用。在前期工作中,分子影像与核医学研究中心李桢团队构建了基于Cu2-xSe多功能超小纳米颗粒,用于调控小胶质细胞功能和神经元功能,提高帕金森疾病的治疗效果。首先,研究团队构建了靶向小胶质细胞、具有多重类酶活性的CSPQ仿生纳米颗粒,通过调控小胶质细胞并将其极化为具有神经保护作用的M2表型,从而缓解氧化应激引起的帕金森症状(J. Am. Chem. Soc. 2020, 142, 21730−21742)。除了小胶质细胞,CSPQ纳米颗粒还可以促进神经元选择性自噬降解α-synuclein聚集体,从而提高帕金森病的治疗效果(Nano Today. 2023, 49, 101770)。其次,研究团队在Cu2-xSe纳米颗粒表面耦联TRPV1抗体,利用Cu2-xSe优异的光热转化效应可控开启小胶质细胞表面的TRPV1离子通道,促进Ca2+内流而增强小胶质细胞的自噬水平和降解α-突触核蛋白聚集体的能力,进而改善帕金森病小鼠的运动和记忆能力(Adv. Mater. 2022, 34, 2108435)。此外,研究团队构建了靶向神经元线粒体的CSCCT仿生纳米颗粒,并通过促进SIRT1依赖的PGC-1α/PPARγ/NRF1/TFAM通路介导线粒体的生物发生,缓解神经元线粒体功能障碍,进而改善帕金森病小鼠的运动和记忆能力(Adv. Sci. 2023, 10, 2300758)。
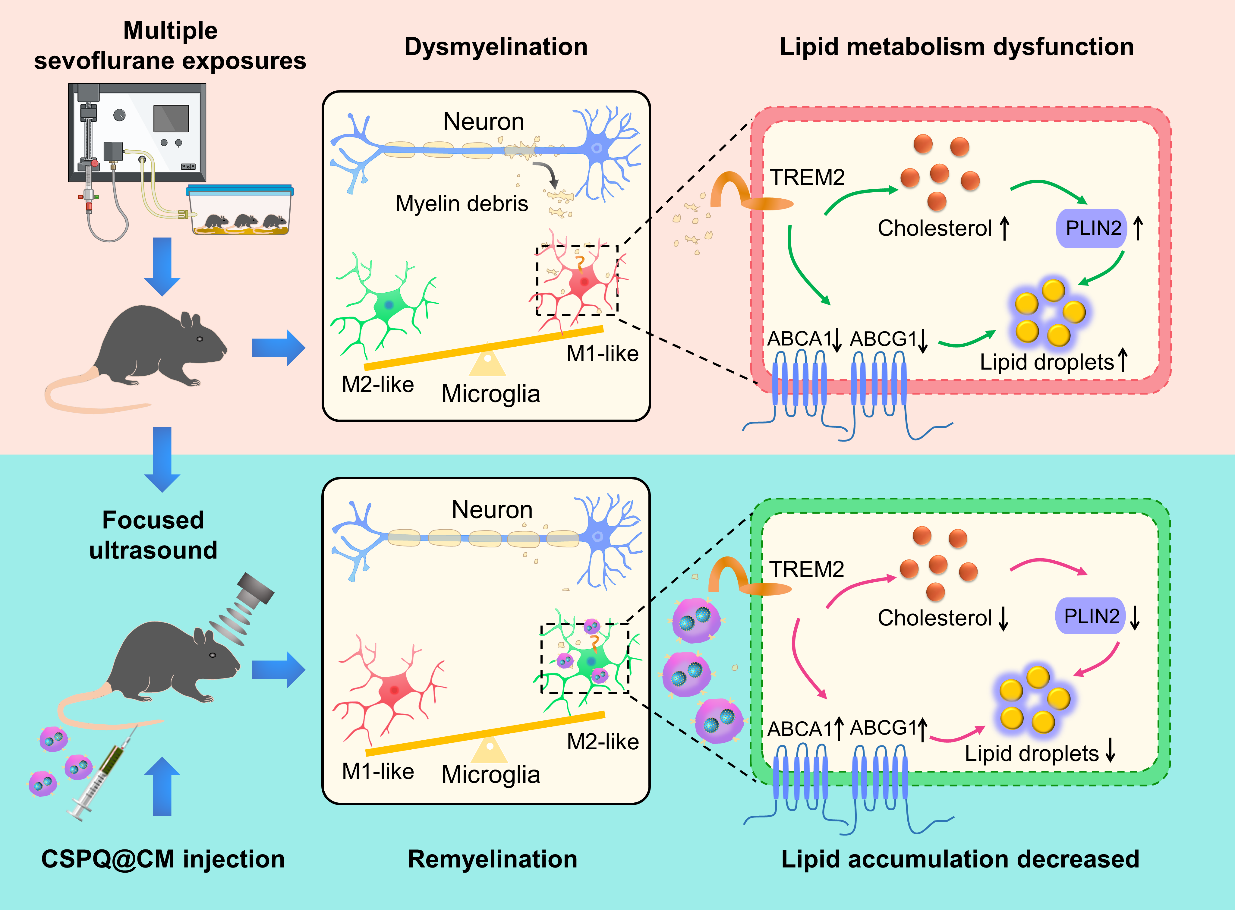
图1.七氟烷神经发育毒性模型建立及CSPQ纳米颗粒促进小胶质细胞内脂滴聚集外排,使小胶质细胞功能恢复稳定,促进髓鞘再生示意图。
基于上述研究基础,研究团队进一步发现靶向小胶质细胞的纳米颗粒(CSPQ@CM)能够上调小胶质细胞表面TREM2(Triggering receptor expressed on myeloid cells 2)的表达,改善小胶质细胞的脂质代谢功能和炎症反应,促进髓鞘再生,从而缓解七氟烷神经发育毒性的分子机制。在该机制中,七氟烷一方面导致海马神经元髓鞘损伤,促使TREM2保护性上调;另一方面过度激活小胶质细胞,使其脂质代谢功能紊乱而导致海马神经元髓鞘再生障碍。CSPQ@CM纳米颗粒靶向小胶质细胞,一方面进一步上调TREM2表达,提高胆固醇转运蛋白ABCA1、ABCG1的表达而促进小胶质细胞内的脂滴代谢,最终达到促进髓鞘再生的目的;另一方面促进小胶质细胞向M2表型极化,从而缓解炎症反应。总之,本研究为治疗七氟烷神经发育毒性或其它小胶质细胞脂滴聚积相关疾病提供了新思路。
需要指出,除了治疗神经退行性疾病之外,超小Cu2-xSe纳米颗粒还具有优异的抗肿瘤性能,是治疗脑胶质瘤以及其它实体肿瘤的理想选择(Adv. Mater. 2016, 28, 8927–8936; ACS Nano, 2017, 11, 5633-5645; Nano Lett, 2018, 18, 4985-4992; ACS Nano, 2019, 13,1342-1353; Adv. Funct. Mater. 2020, 30, 1906128; Adv. Funct. Mater. 2022, 32, 2108971; Nano Today. 2022, 46, 101601; Bioact. Mater. 2022, 16, 418-432; Adv. Sci. 2023, 10, 2204961)。
苏州大学放射医学与防护学院李桢教授与苏州大学附属第一医院嵇富海教授为共同通讯作者,2021级硕士联培研究生李文婷及苏州大学附属第一医院孟晓文为共同第一作者。该工作得到国家自然科学基金、国家重点研发计划等项目资助。